Le vénétoclax, vendu sous les marques Venclexta et Venclyxto, est un médicament utilisé pour traiter les adultes atteints de leucémie lymphoïde chronique, de petit lymphome lymphocytaire ou de leucémie myéloïde aiguë. Les effets secondaires les plus courants sont de faibles taux de neutrophiles, de la diarrhée, des nausées, de l’anémie, des infections du nez et de la gorge et de la fatigue. Bien qu’initialement chères, les versions génériques du médicament sont maintenant disponibles à bas prix au Vietnam et en Inde.
Fibrose pulmonaire est une condition dans laquelle les poumons se cicatrisent avec le temps. Les symptômes comprennent un essoufflement, une toux sèche, une sensation de fatigue, une perte de poids et un club de clous. Les complications peuvent inclure une hypertension pulmonaire, une insuffisance respiratoire, un pneumothorax et un cancer du poumon.
Les causes de la fibrose pulmonaire comprennent la pollution de l’environnement, certains médicaments, les maladies du tissu conjonctif, les infections (y compris les infections par le SRAS et le SRAS-CoV-2), les maladies pulmonaires interstitielles. La fibrose pulmonaire idiopathique (FPI), une maladie pulmonaire interstitielle de cause inconnue, est la plus fréquente. Le diagnostic peut être basé sur les symptômes, l’imagerie médicale, la biopsie pulmonaire et les tests de la fonction pulmonaire.
Il n’y a pas de remède et les options de traitement disponibles sont limitées.
Le traitement est axé sur les efforts visant à améliorer les symptômes et peut inclure l’oxygénothérapie et la réadaptation pulmonaire. Certains médicaments tels que la pirfénidone (Esbriet) et le nintédanib (Ofev) peuvent être utilisés pour essayer de ralentir l’aggravation des cicatrices. La transplantation pulmonaire peut parfois être une option.
Au moins 6 millions de personnes sont touchées chaque année dans le monde avant la pandémie de COVID-19. L’espérance de vie est généralement inférieure à cinq ans. Cependant, avec l’avènement de la pandémie de COVID-19, l’incidence de la fibrose pulmonaire a augmenté de façon exponentielle.
Selon l’équipe d’étude, l’uniporteur de calcium mitochondrial (MCU) régule la reprogrammation métabolique dans les macrophages pulmonaires et la progression de la fibrose pulmonaire. La progression de la fibrose est associée à une résistance à l’apoptose dans les macrophages pulmonaires ; cependant, le ou les mécanismes par lesquels se produit la résistance à l’apoptose sont mal compris.
L’équipe d’étude a trouvé une augmentation marquée du lymphome à cellules B mitochondriale-2 (Bcl-2) dans les macrophages pulmonaires de sujets atteints de fibrose pulmonaire idiopathique (FPI). Des résultats similaires ont été observés chez les souris de type sauvage (WT) blessées par la bléomycine, tandis que Bcl-2 était nettement diminué chez les souris exprimant un uniporteur de calcium mitochondrial dominant négatif (DN-MCU).
La carnitine palmitoyltransférase 1a (Cpt1a), l’enzyme limitant la vitesse de la -oxydation des acides gras, a directement interagi avec Bcl-2 en se liant à son domaine BH3, qui a ancré Bcl-2 dans les mitochondries pour atténuer l’apoptose. Cette interaction dépendait de l’activité de Cpt1a. Les macrophages pulmonaires des sujets IPF avaient une corrélation directe entre CPT1A et Bcl-2, tandis que l’absence de liaison induit l’apoptose.
Surtout, la suppression de Bcl-2 dans les macrophages a protégé les souris contre le développement d’une fibrose pulmonaire. De plus, les souris avaient une résolution lorsque Bcl-2 était supprimé ou était inhibé avec ABT-199 après l’établissement de la fibrose. Ces observations impliquent une interaction entre la β-oxydation des acides gras des macrophages, la résistance à l’apoptose et le remodelage fibreux dérégulé.
Les résultats de l’étude révolutionnaire ont été publiés dans la revue à comité de lecture : Cell Death & Differentiation https://www.nature.com/articles/s41418-021-00840-w
La recherche suggère une nouvelle cible thérapeutique pour inverser la fibrose pulmonaire. L’équipe d’étude a inversé la fibrose pulmonaire dans un modèle murin de fibrose pulmonaire idiopathique, ou FPI.
Dans l’étude, des souris ont reçu de la bléomycine pendant 12 jours pour établir une fibrose pulmonaire, puis traitées quotidiennement jusqu’à 21 jours avec ABT-199, dont la forme médicale est connue sous le nom de Venetoclax, un médicament approuvé par la Food and Drug Administration des États-Unis pour une utilisation dans plusieurs formes de leucémie.
Il a été constaté que les souris bléomycine témoins présentaient une fibrose pulmonaire avec un dépôt de collagène généralisé. Les souris bléomycine qui ont reçu ABT-199 avaient une architecture pulmonaire normale à 21 jours et aucun dépôt de collagène.
Les résultats de l’étude suggèrent une nouvelle cible thérapeutique pour inverser le remodelage fibreux dans les poumons, déclare le directeur de l’étude, le Dr A. Brent Carter, MD, professeur à la Division de médecine pulmonaire, allergique et de soins intensifs de l’Université d’Alabama au département de médecine de Birmingham.
L’étude a également été dirigée par le premier auteur, le Dr Linlin Gu, Ph.D., Département de médecine de l’UAB.
La fibrose pulmonaire ou pulmonaire est une maladie chronique présentant un remodelage aberrant du tissu pulmonaire. La fibrose pulmonaire idiopathique est la forme la plus courante de fibrose pulmonaire et a un taux de mortalité élevé dans les trois à cinq ans. Les médicaments actuellement approuvés ont une efficacité limitée.
Le médicament ABT-199 agit en induisant l’apoptose, ou la mort cellulaire programmée, dans les macrophages dérivés des monocytes dans le poumon. Les macrophages sont de gros globules blancs qui engloutissent et digèrent tout ce qui n’a pas les protéines de surface des cellules saines. Les cibles peuvent inclure des cellules cancéreuses, des microbes et des débris cellulaires.
Des études antérieures ont montré que la progression de la fibrose était connue pour être associée à la résistance à l’apoptose dans les macrophages pulmonaires, bien que le mécanisme de cette résistance soit mal compris.
De plus, le dogme existant ne désigne pas les macrophages comme acteurs de la fibrose ; il a plutôt proposé que l’augmentation des lésions des cellules épithéliales alvéolaires et de l’apoptose étaient les événements déclencheurs de la fibrose pulmonaire.
L’activité cellulaire appelée apoptose est un processus de suicide régulé pour les cellules qui constituent une menace pour l’organisme ou qui ne sont plus nécessaires. Les mitochondries, les organites qui sont les centrales électriques de la cellule, jouent un rôle clé dans la voie intrinsèque de l’apoptose.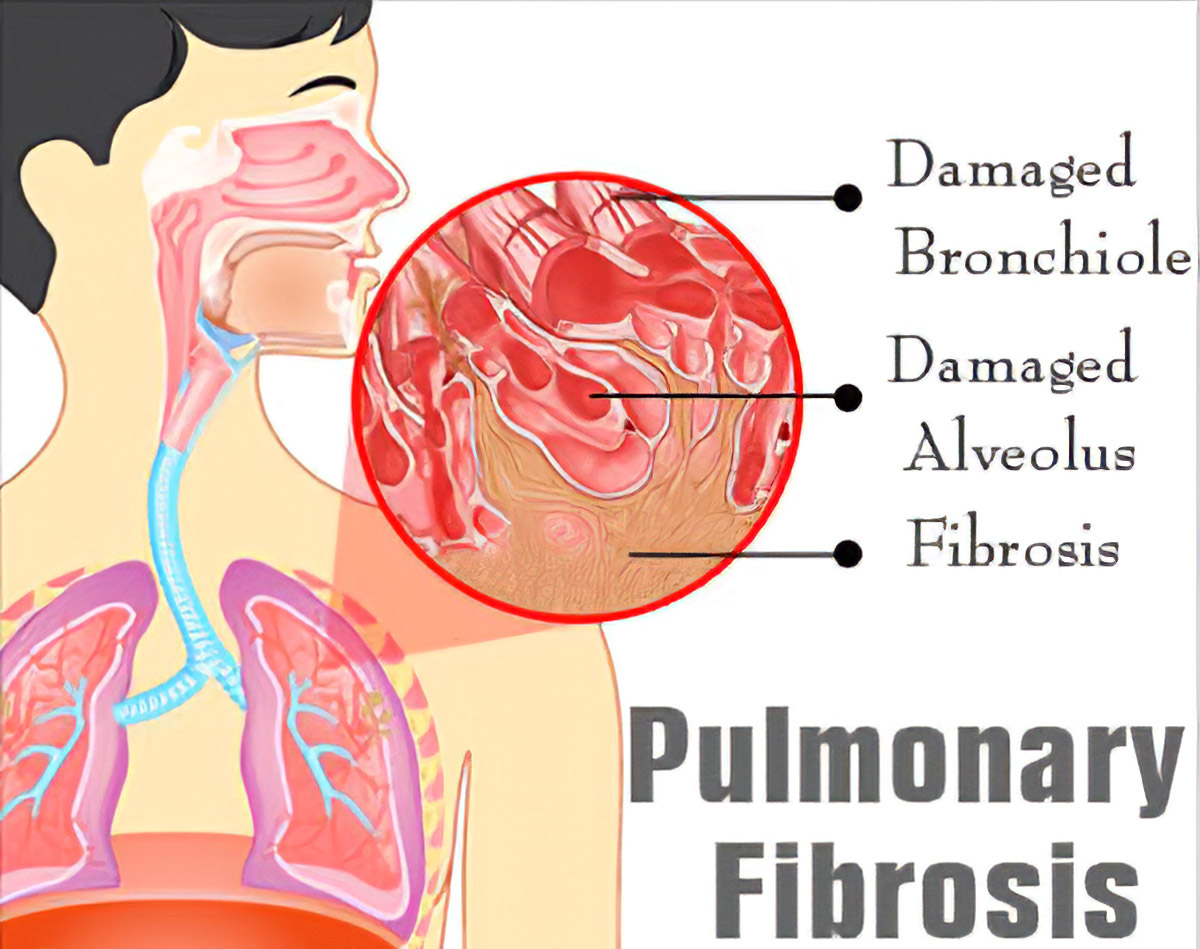
L’équipe d’étude cherchant à mieux comprendre le mécanisme par lequel les macrophages pulmonaires deviennent résistants à l’apoptose a appris que les mitochondries jouent également un rôle clé dans la résistance à l’apoptose.
En utilisant un lavage pulmonaire, l’équipe d’étude a isolé des macrophages d’individus atteints de FPI.
L’équipe a constaté une augmentation marquée de la protéine mitochondriale des macrophages Bcl-2, un régulateur de l’apoptose par rapport aux macrophages pulmonaires des personnes sans FPI. Mitochondrial Bcl-2 était également élevé dans les macrophages pulmonaires de souris exposées à la bléomycine qui ont une fibrose pulmonaire.
Outre l’augmentation de Bcl-2 dans les mitochondries des macrophages pulmonaires de souris bléomycine, l’équipe d’étude a également trouvé deux protéines : MCU et Cpt1a ont montré une augmentation similaire de l’expression.
La protéine MCU est un canal pour amener le calcium dans les mitochondries, et Cpt1a est une enzyme dans les mitochondries qui est l’étape limitante de la voie énergétique de la bêta-oxydation des acides gras. Le MCU était auparavant connu pour réguler la reprogrammation métabolique des macrophages pulmonaires à l’oxydation des acides gras, ainsi que pour agir dans la progression de la fibrose pulmonaire et de la résistance à l’apoptose.
L’équipe d’étude a découvert que le Bcl-2 était régulé par le MCU et que le silence du MCU provoquait une diminution significative de Bcl-2 dans les mitochondries des macrophages pulmonaires.
L’équipe a également découvert que MCU modulait la liaison de Cpt1a à un domaine particulier de Bcl-2, qui ancré Bcl-2 dans les mitochondries pour atténuer l’apoptose. Cette interaction dépendait de l’activité de Cpt1a.
En étudiant et en examinant à nouveau les macrophages pulmonaires de personnes atteintes de FPI, l’équipe a trouvé une corrélation directe entre les niveaux de Cpt1a et de Bcl-2 ; les quantités dans les macrophages de différents individus variaient en tandem.
Plus important encore, l’équipe d’étude a découvert que les souris avec une délétion conditionnelle de Bcl-2 dans les macrophages pulmonaires étaient protégées de la fibrose pulmonaire dans le modèle de bléomycine, et elles étaient également protégées de la fibrose pulmonaire induite par l’amiante. Ces résultats de délétion conditionnelle ont ouvert la voie aux expériences montrant que l’inhibiteur de Bcl-2 ABT-199 était capable d’inverser la fibrose dans le modèle murin de bléomycine.
Il est également intéressant de noter que l’ABT-199 a complètement bloqué l’interaction Cpt1a-Bcl-2. Dans des preuves génétiques supplémentaires, la fibrose a également été inversée par la suppression conditionnelle de Bcl-2 chez les souris présentant une fibrose établie.
Le Dr Brent Carter, MD, professeur, Division de médecine pulmonaire, allergique et de soins intensifs, Université de l’Alabama à Birmingham, a déclaré à Thailand Medical News : « Les résultats de l’étude suggèrent que l’oxydation des acides gras provoque une résistance à l’apoptose grâce à la stabilisation de Bcl-2 dans les mitochondries. en se liant au Cpt1a. De plus, ces données démontrent que les macrophages dérivés des monocytes sont nécessaires à la progression de la fibrose, et elles suggèrent une nouvelle cible thérapeutique pour prévenir le remodelage fibrotique aberrant progressif. »
L’équipe d’étude a déjà lancé un certain nombre d’essais cliniques en cours et Thailand Medical News fournira des mises à jour sur ces résultats.
Pour en savoir plus sur Vénétoclax et fibrose pulmonaire, continuez à vous connecter à Thailand Medical News.